分子细胞科学卓越创新中心惠利健组利用微囊化可增殖人肝细胞类器官实现肝衰竭治疗
文章来源:分子细胞科学卓越创新中心 | 发布时间:2024-03-07 | 【】 【】
3月8日,国际学术期刊cell stem cell在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)惠利健研究组的最新研究成果:“preclinical efficacy and safety of encapsulated proliferating human hepatocyte organoids in treating liver failure”。该项研究实现了大规模制备海藻酸钠微胶囊包裹的可增殖人肝细胞类器官(encapsulated prolihhs liver organoids,elo),并在80%肝切术后肝衰竭模型和药物对乙酰氨基酚(acetaminophen,apap)诱导的肝衰竭小鼠模型中证明了elo腹腔移植的治疗有效性。在术后肝衰竭中,elo通过维持肝肠轴的稳态改善肝衰竭,保护肠道屏障,减少肠道来源的内毒素,从而促进肝脏再生等机制来改善肝衰竭。最后,研究团队验证了prolihh细胞的基因组稳定性及elo移植的体内安全性,为正在进行的elo临床研究奠定了坚实的基础。目前该研究在iit(investigator initiated trial)临床研究中。
在该研究中,惠利健团队的研究人员首先对批量生产的elo进行了细胞活力和肝细胞成熟功能的鉴定,发现elo的细胞活力维持在85%以上,与未经微胶囊包裹的prolihh类器官(liver organoids,lo)相当,并且elo与lo具有相当的成熟肝基因表达水平、蛋白分泌以及相似的代谢活性,证明了微胶囊包裹不影响lo成熟的肝细胞功能。
模拟临床术后肝衰竭和小肝综合症,研究人员构建了80%肝切诱导的肝衰竭模型(extended 80% partial hepatectomy,eph),并将elo注射到小鼠腹腔中,发现微囊化能形成免疫保护屏障,使得移植的lo体内7天内维持较好的功能,并使后续移植的细胞回收成为可能。研究发现5%肝质量 (5x106)的肝细胞对eph小鼠具有显著的治疗效果。与空微囊治疗组相比,elo治疗组的小鼠生存率提高,伴随着ast、alt等肝损伤生化指标下降,凝血功能、降血氨能力等肝脏功能有明显的恢复,以及il-6、tnf-α等炎症指标降低。同时,在elo治疗组的小鼠肝脏中,观察到在肝切后第2天开始有大量肝细胞增殖,在第14天时肝体重比恢复到与正常小鼠相似的水平,并且第14天elo治疗组小鼠肝脏的转录组也接近正常肝脏。此外,研究团队证明elo对apap诱导的肝衰竭小鼠也具有显著的治疗效果。
随后,研究人员对elo治疗eph的作用机制进行了探究。通过对从eph小鼠腹腔中回收的elo进行基因表达水平、蛋白合成水平及染色分析,证明elo具有氨代谢、尿素合成和糖原储存的能力,可以改善eph小鼠高血氨和低血糖等症状。为了研究elo肝脏再生的促进作用,研究人员发现与空微囊治疗组相比,elo治疗组小鼠的肠道形态和通透性更接近于正常小鼠,肠道来源的血清内毒素水平也显著降低,继而elo治疗组小鼠的炎症因子水平下降,减轻了肝脏炎症,有利于肝脏的再生。由于elo治疗后,与空微囊对照组小鼠相比,总胆汁酸水平显著下降,而积累的胆汁酸会破坏肠道屏障,增加肠道通透性,研究人员利用肝切后水平显著上升的胆酸(1% cholic acid)饲喂eph小鼠去增加小鼠肠道通透性,发现即使给予elo 治疗,小鼠的生存率显著降低,同时炎症因子il-6水平显著上调。这些实验数据表明,elo治疗除了提供肝功能支持外,还通过保护肠道屏障,降低肠道来源的内毒素来帮助肝脏再生。
研究人员对elo的生物分布、毒理和致瘤性进行了分析,血液学毒性、血生化指标和解剖病理学检测结果都证明了elo移植的安全性。同时,在体外,通过核型鉴定和全基因组测序,鉴定体外培养的prolihh的基因组稳定性和prolihh致瘤性,进一步验证该细胞的安全性。
综上所述,该研究实现了大规模制备海藻酸钠微胶囊包裹的可增殖人肝细胞类器官,并在80%肝切和对乙酰氨基酚诱导的肝衰竭小鼠模型中证明了elo腹腔移植的有效性。同时,研究团队在小鼠模型中验证了细胞的基因组稳定性及elo移植的体内安全性,为正在进行的elo临床研究奠定了坚实的基础。
分子细胞卓越中心袁湘博士和博士生吴婧琪为该论文共同第一作者,惠利健研究员为该论文通讯作者。该项工作得到中国科学院、基金委、科技部、上海市科委等项目的资助,以及分子细胞卓越中心分子生物学技术平台、细胞分析技术平台、化学生物学技术平台、动物实验技术平台和细胞库/干细胞技术平台的帮助与支持。
文章链接:
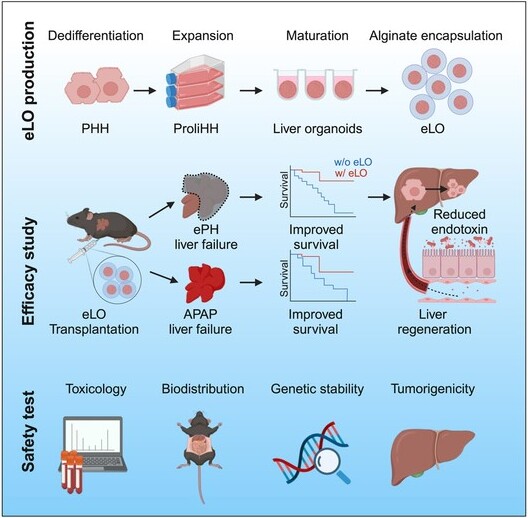
微囊化肝细胞类器官移植治疗肝衰竭的有效性和安全性研究的图解摘要
