国科学院脑科学与智能技术卓越创新中心建立高通量解析单神经元投射组和转录组的新技术
文章来源:脑科学与智能技术卓越创新中心 | 发布时间:2024-02-24 | 【】 【】
2024年02月23日,《elife》期刊在线发表题为《》的研究论文。该研究由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)陈跃军研究组、上海科技大学罗振革研究组以及临港实验室李澄宇研究组合作完成。该研究通过融合高通量单细胞测序技术和逆向病毒分子条码标记技术,建立了merge-seq技术,实现了对脑内单个神经元的转录组和投射组的同时捕获。研究以腹内侧前额叶皮层(vmpfc)为例,在单神经元水平解析了vmpfc神经元投射到下游不同脑区的投射模式和相应的分子特征,为进一步从单细胞多模态角度理解大脑神经回路及信息处理机制的组织原理提供了底层技术支撑。
解密大脑中神经元之间的连结模式对于理解大脑功能至关重要。利用成像技术进行的神经解剖学追踪能够识别从区域到区域或者是单个神经元之间的连接模式(如fmost),然而这种方法的通量受限,且需要大量的神经元形态重构的工作。而基于条形码的连接组学则能够高通量绘制出大量单个神经元的投射组(如mapseq、bricseq和barseq)。然而,除了复杂的神经元投射模式外,大脑中神经元的类型和分子表达谱也高度多样化,如何获取并整合分析单个神经元的投射模式与分子特征,依然面临挑战。
内侧前额叶皮层(mpfc)是一个复杂的大脑区域,参与高阶认知功能、信息处理(例如记忆和情绪)以及驱动目标导向的行动。尽管之前的研究已广泛探究了mpfc的投射模式和功能多样性,但mpfc神经元的投射模式和分子特征之间的关系仍然不明确。尚未完全明确的科学问题包括:投射到相同下游脑区的mpfc神经元在它们的转录组上是否存在差异?其是相同还是不同类型/亚型的神经元?具有分支投射的mpfc神经元的下游投射位点选择的规律是什么?这些“广播”神经元(broadcasting neurons)的细胞类型和分子特征是什么?
基于上述科学问题和技术挑战,研究人员设计了一种多重神经元逆向追踪的方法,能够同时对单个神经元的转录组和投射组进行记录,称之为merge-seq(multiplexed projection neurons retrograde barcode)。研究人员向vmpfc的五个已知下游目标区域注射了带有不同条码的逆行aav 病毒(raav2-retro),包括非颗粒岛皮质(agranular insular cortex, ai)、背内侧纹状体(dorsomedial striatum, dms)、基底杏仁核(basolateral amygdala, bla)、丘脑背内侧核(mediodorsal thalamic nucleus, md)和外侧下丘脑(lateral hypothalamus, lh),使得每个目标区域都被注射带有唯一分子条形码的逆行aav 病毒。病毒于vmpfc投射在下游脑区的突触末梢吸收,并逆行至上游的vmpfc神经元胞体并转录。单个神经元胞体转录产生的分子条形码代表对应的下游脑区,并在后续构建的投射组文库中被捕获。与此同时,单个神经元的转录组也可以通过常规的3'端或全长单细胞测序技术捕获(本研究中使用3’端10x genomics测序技术为例)。
研究发现,投射到相同下游脑区的vmpfc神经元在转录组上是异质的,由转录组上不同的神经元亚型组成。根据选定的五个下游脑区的merge-seq数据,研究人员发现vmpfc神经元既有专一的投射模式(单神经元仅投射一个下游脑区),也有分支投射模式(单神经元投射到多个下游脑区)。研究人员进一步揭示了这些专一和分支投射的vmpfc神经元的细胞类型组成和皮层分布,并揭示了它们的分子特征。通过与近期脑智中心严军研究团队发表的基于fmost的单神经元投射组数据的联合分析,研究人员进一步验证了merge-seq推断的vmpfc脑区单神经元的投射模式。此外,使用rna荧光原位杂交(fish)和双色逆行aav标记技术,研究人员验证了皮层第五层pou3f1阳性的vmpfc神经元对dms和lh的分支投射。最后,得益于merge-seq单细胞多模态的数据结构,即两种模态的数据(投射组与转录组)共享一个坐标系统(同一个细胞),研究人员使用基于机器学习的模型构建与模型解释方法,发现了可用于预测特定投射模式的特定基因簇,为整合现有的单细胞多模态的大规模脑图谱数据提供范例。
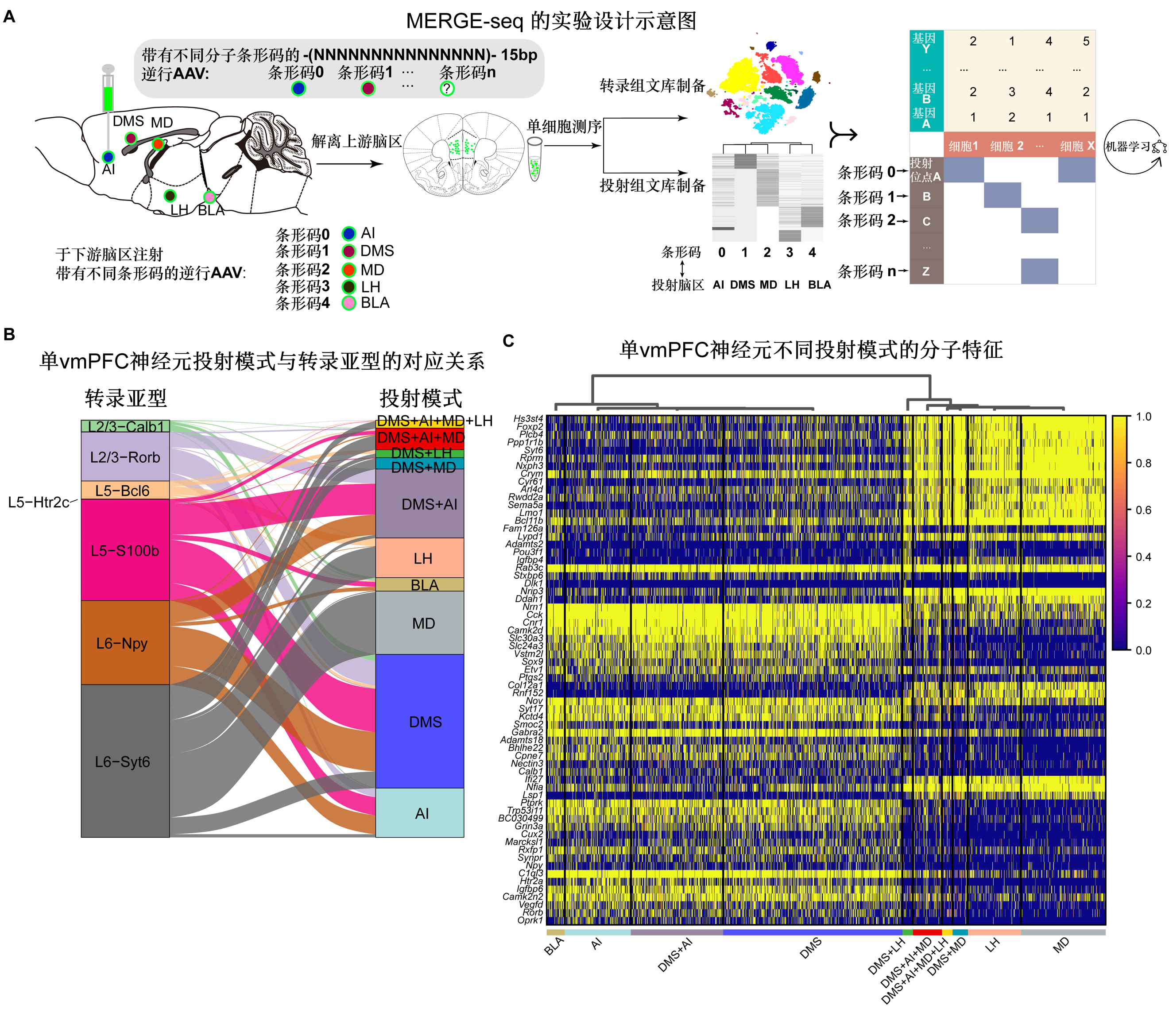
a. merge-seq实验设计与分析示意图。b.冲击图(alluvial plot)显示了10种最频繁的vmpfc投射模式在不同vmpfc神经元亚型的分布。c. 10种vmpfc投射模式定义的细胞群的差异表达基因热图。
值得一提的是,该工作是陈跃军研究组应用分子条形码结合高通量单细胞测序的第三项工作。之前的工作包括对(2023 cell stem cell, cover story)以及(2023 nature methods)。本研究进一步扩展分子条形码技术,成功将其应用于多模态解析大脑复杂的神经连接组。
脑智卓越中心陈跃军研究员、上海科技大学罗振革研究员、临港实验室李澄宇研究员与脑智卓越中心博士研究生许培博为本论文的共同通讯作者。陈跃军组博士研究生许培博、罗振革组博士研究生彭建、陈跃军组袁停利、李澄宇组高级工程师陈兆琴、陈跃军组博士研究生何慧为该论文共同第一作者,陈跃军组吴子彦博士和罗振革组博士研究生李婷对实验做出重要贡献。博士研究生李効东、王露悦博士和临港实验室魏武研究员对生物信息学分析提供了重要支持。脑智卓越中心严军研究员和高乐博士对vmpfc单神经元fmost数据的提取提供重要支持。 此外脑智卓越中心光学平台与分子细胞平台提供了重要j9九游会登录入口首页旧版的技术支持。该研究得到科技部、中国科学院、上海市、基金委项目的支持。
