分子细胞科学卓越创新中心揭示人线粒体trna t6a修饰对线粒体基因表达调控的多重作用
文章来源:分子细胞科学卓越创新中心 | 发布时间:2024-01-17 | 【】 【】
1月16日,国际学术期刊nucleic acids research在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周小龙研究组与王恩多研究组的最新合作研究成果“multifaceted roles of t6a biogenesis in efficiency and fidelity of mitochondrial gene expression”。该项工作揭示了人线粒体trna n6-苏氨酰基甲腺苷酸(t6a)修饰对线粒体基因表达调控的多重作用。
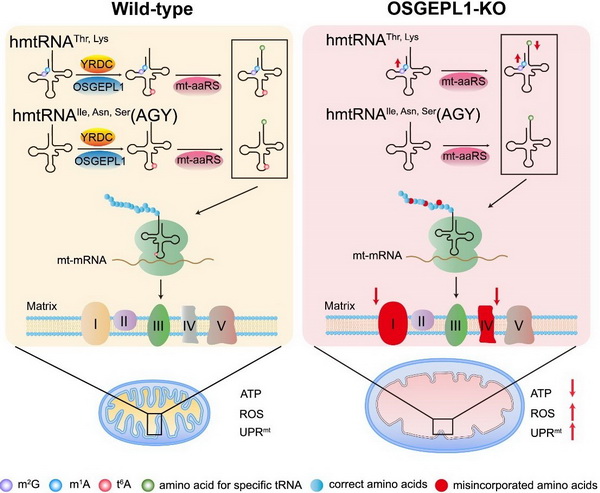
转移核糖核酸(trna)在细胞内所有核酸分子中含有最多的转录后修饰,这些化学修饰对于稳定trna的结构和功能十分重要。其中,t6a修饰高度保守,仅发生在解码ann(n = a, t, g, c)密码子的trna的37位腺嘌呤(t6a37)上。人线粒体trna t6a37修饰由yrdc与osgepl1 共同催化完成。研究组前期工作已经阐释osgepl1催化t6a37修饰的生化基础,但t6a37修饰在哺乳动物线粒体mrna翻译过程中发挥的功能尚不清楚。
在该项研究中,研究人员通过crispr-cas9技术在hek293t细胞上构建了敲除osgepl1基因的ko细胞系,发现t6a37修饰的缺失会专一地上调线粒体trnathr和trnalys上第9位n1-甲基腺嘌呤(m1a9)和第10位n2-甲基鸟嘌呤(m2g10)修饰;此外,缺失t6a37修饰也会专一地下调线粒体trnathr和trnalys的氨基酰化水平。通过分离线粒体氧化磷酸化超复合物并进行蛋白质质谱分析,研究人员发现t6a37修饰的缺失会使临近的u36不仅与mrna上密码子的第1位a配对,还错误识别密码子第一位的其他非对应核苷酸(g/c/u),导致多种线粒体遗传密码被错误解码。线粒体翻译效率及保真性的下降导致线粒体氧化磷酸化复合物含量及活力下降,并进一步导致线粒体结构及功能的异常、激活线粒体非折叠蛋白质反应(uprmt)。研究人员进一步构建了osgepl1全身敲除的小鼠并重点研究了该小鼠的心脏功能。发现osgepl1-ko小鼠心脏线粒体编码的mt-cox2和mt-cox3的表达量显著下降,但这一变化还不足以影响心脏线粒体氧化磷酸化复合物的组装,也没有对osgepl1-ko小鼠的心脏功能及寿命产生明显影响。
该研究首次发现线粒体trna t6a37修饰与m1a9,m2g10修饰的协同调控;系统揭示t6a37修饰对线粒体trna氨基酰化水平的影响;阐明线粒体trna t6a37修饰缺失影响线粒体密码子解码保真性失调的机制。以上结果加深了人们对线粒体trna修饰的生物学功能的认识。
分子细胞卓越中心博士研究生张勇与周敬波为该文共同第一作者,周小龙研究员与王恩多研究员为该文共同通讯作者。国家蛋白质科学中心(上海)殷跃博士参与了该研究。感谢分子细胞卓越中心分子生物学技术平台的大力支持。该研究得到了科技部、国家自然科学基金委、中国科学院、上海市科委的经费资助。
文章链接:
线粒体trna t6a修饰对线粒体基因表达调控的多重作用
