杜雅蕊/徐国良团队揭示双加氧酶的低复杂度结构域调控dna氧化去甲基化
文章来源:分子细胞科学卓越创新中心 | 发布时间:2024-01-05 | 【】 【】
1月4日,nature structural & molecular biology在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)杜雅蕊/徐国良团队的研究成果:“auto-suppression of tet dioxygenases protects the mouse oocyte genome from oxidative demethylation”。该研究揭示tet双加氧酶催化活性中心的一个低复杂度结构域(low complexity domain,lcd)介导该家族蛋白的酶活负调控,阐述了lcd保护卵母细胞甲基化组免受过度氧化的重要作用,显示dna甲基化谱式的正常建立对于哺乳动物发育至关重要。
以5-甲基胞嘧啶(5-methylcytosine, 5mc)为主的dna甲基化是表观遗传调控的重要方式,在调控基因表达、建立基因印记、维持x染色体失活和转座子沉默等生理过程中发挥重要作用。dna甲基转移酶(dna methyltransferases, dnmts)和tet双加氧酶(tet dioxygenases)共同调控dna甲基化谱式的形成。tet双加氧酶介导的dna氧化去甲基化的发现是近年来染色质与细胞命运研究领域的一大突破。然而,迄今为止对于tet蛋白的研究主要局限于基因敲除实验。人们对tet双加氧酶对5mc的时空和基因组位点特异性氧化的机制还缺乏了解。
在该项研究中,研究人员发现lcd缺失的tet3突变体的酶活显著增强。不同于以往对于tet蛋白的研究局限于功能丧失的方法,研究人员利用独到的基于孤雄单倍体干细胞技术的基因编辑策略,构建了酶活增强的小鼠模型,发现卵子发生过程中tet3的酶活受到精密调控:在野生型小鼠中,tet3从卵母细胞时期就开始高表达,但其功能在卵子发生过程中受到抑制,受精之后才开始发挥其氧化去甲基化的功能;而卵母细胞中lcd的缺失解除了tet3的酶活自抑制,使小鼠卵母细胞基因组5mc发生过度氧化。进一步研究发现,tet3 lcd突变蛋白倾向作用于原本高度甲基化的ervk元件和母本印迹基因,且5mc高级氧化产物的产生伴随着h3k9me3水平的降低,从而解除了对ervk等逆转座元件的双重抑制,影响了ervk附近卵子发生相关基因的表达,最终导致卵母细胞及后续胚胎发育受损。该研究揭示了位于蛋白催化活性中心的低复杂度结构域lcd对tet酶活的调控方式和生物学意义,拓宽了人们对tet酶活时空特异性调控的理解。
分子细胞卓越中心博士研究生张晓洁、韩斌斌、邵震宇、中国科学院动物研究所博士研究生燕蕊以及分子细胞卓越中心高级实验师高娟为该论文共同第一作者。分子细胞卓越中心杜雅蕊研究员、徐国良研究员为该论文共同通讯作者。中国科学院动物研究所郭帆研究员、中国科学院生态环境研究中心汪海林研究员、英国奥斯特大学的colum p. walsh教授以及分子细胞卓越中心李劲松研究员和吴立刚研究员对该工作给予了大力支持。该项工作得到了中国科学院、基金委、科技部等项目的资助以及分子细胞卓越中心动物实验技术平台和细胞分析技术平台的帮助与支持。
文章链接:
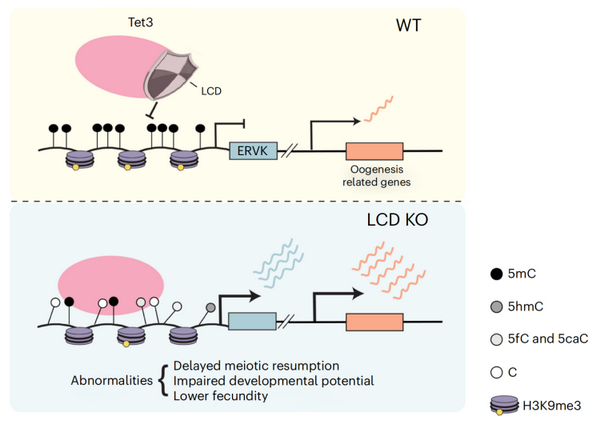
tet3 lcd作用机制的工作模型
