杜久林研究组发现血流调节大脑周细胞发育
文章来源:脑科学与智能技术卓越创新中心 | 发布时间:2024-01-04 | 【】 【】
大脑运作依赖复杂而高效的血管网络为其提供营养物质并带走代谢废物。为维持神经组织的稳态和正常神经活动,脑血管在发育过程中形成了血脑屏障,以严格控制血液与脑实质之间的物质交换。血脑屏障的异常与包括阿兹海默症在内的多种脑疾病紧密相关。周细胞作为毛细血管中贴附内皮细胞管腔外侧的壁细胞,对维持血脑屏障的完整性起到关键作用。因此,解析大脑周细胞的发育过程对探索血脑屏障的形成和维持的机制至关重要。先前的研究表明,血流作为血管最重要的功能表现形式,参与调节了大脑血管内皮细胞的发育。然而,血流是否影响大脑周细胞的发育目前仍不清楚。
研究人员利用斑马鱼作为模式脊椎动物,通过crispr/cas9基因敲入技术构建了特异性标记周细胞的在体研究模型。通过在体长时程连续成像,发现大脑周细胞最早来源于脑周血管上的前体细胞,迁移入脑后在脑内进行分裂,这是脑内周细胞数目增长的主要方式。通过药理学手段改变血流速度,发现血流上调大脑血管上周细胞的覆盖密度,这种调节主要是通过促进大脑周细胞的分裂实现的。进一步地,研究人员发现,血管内皮细胞上表达的机械敏感性阳离子通道piezo1感应血流变化,介导血流对周细胞分裂的调节。
血流的作用是如何从血管内皮细胞传递到周细胞的呢?研究人员发现,piezo1的激活显著提高了内皮细胞中notch信号的活性。特异性升高或抑制血管内皮细胞内在的notch信号活性,导致大脑周细胞的分裂速率出现相应的上调或下调。在血管内皮细胞notch信号被抑制的情况下增加血流速度和piezo1活性,均无法引起大脑血管上周细胞密度发生明显的变化,表明血管内皮细胞内在的notch信号作为piezo1的下游介导了血流对大脑周细胞发育的调节。此外,通过特异性增强或抑制血管内皮细胞中notch信号的向外传递,研究人员进一步提供了血管内皮细胞中notch信号直接激活周细胞中的notch信号进而促进周细胞分裂的证据。
该研究揭示了血流调控脑血管发育的新机制,为进一步研究大脑周细胞的发育提供了的视角。同时,对于正在努力寻找治疗神经系统疾病方法的研究人员来说,这一发现可能提供新的治疗策略。例如,通过上调血管内皮细胞中piezo1活性或者notch信号强度,有助于增加周细胞的增殖,从而改善脑血管功能,有利于阿兹海默症、血管性痴呆、脑卒中等疾病患者脑功能的恢复。
杜久林研究员与李佳副研究员为本论文的通讯作者,杜久林组博士后訾化星为本论文的第一作者,助理研究员彭小兰参与了该课题中的斑马鱼在体动态成像实验,研究生解天意、刘亭亭博士、李红羽博士和卜纪雯对课题中涉及的重要斑马鱼品系的制作做出了重要贡献;此外,温州医科大学附属浙江省台州医院曹建斌参与了该课题的药理学实验;中国科学院脑智卓越中心光学平台提供了重要j9九游会登录入口首页旧版的技术支持。该研究获得了科技部国家重点研发计划、国家自然科学基金、上海市自然科学基金、sa-sibs优秀人才奖励基金和中科院青促会的资助。
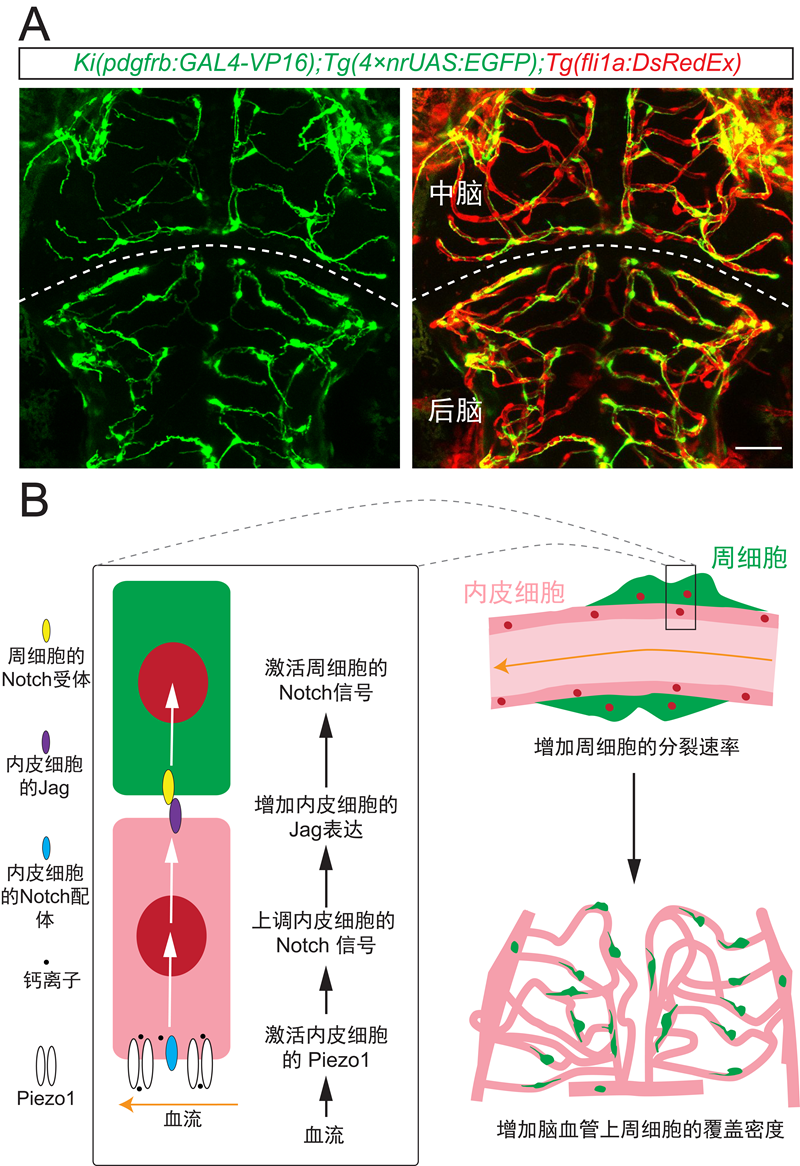
a. 斑马鱼胚胎大脑血管(红色)和周细胞(绿色)的在体成像。b. 血流调节大脑周细胞发育的机制模式图。血流激活血管内皮细胞的piezo1,引起内皮细胞notch信号的上调,促使血管内皮细胞表达更多的notch配体jag,进而激活周细胞中的notch信号,最终促进大脑周细胞的分裂,增加其对脑血管的覆盖。
