程红组合作揭示sap30bp对cdk11调控剪接功能的关键激活作用
文章来源:分子细胞科学卓越创新中心 | 发布时间:2023-12-19 | 【】 【】
12月7日,国际学术期刊the embo journal在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)程红研究组和武汉大学周宇研究组以及大连化学物理研究所叶明亮研究组的最新合作研究成果“cdk11 requires a critical activator sap30bp to regulate pre-mrna splicing”。本研究发现了一个全新的pre-mrna剪接因子sap30bp,并揭示了它通过激活cdk11促进sf3b1等剪接因子的磷酸化,调控全局mrna剪接的分子机制。
前体mrna的剪接是重要的转录后调控机制之一。cdk11是一个新兴的癌症治疗药物靶点,因为它在磷酸化关键转录和剪接因子以及促进癌细胞的细胞周期进程中发挥着重要作用。像其它细胞周期蛋白依赖性激酶一样,cdk11需要cyclin l1或cyclin l2来激活。然而,对于cdk11的活性激活是否需要其他因子的协助,目前尚不清楚。研究人员构建了sap30bp-dtag快速降解敲入细胞系,发现sap30bp确实直接调控全局组成型rna剪接。进一步发现sap30bp主要定位在核斑小体(nuclear speckles)中,并结合大量的核心剪接因子。其中,重点关注了免疫沉淀中被非常显著富集的cdk11和cyclins l1/l2。利用多种生化实验并结合转录组测序,研究人员发现sap30bp与cdk11和cyclin l能够直接互作,形成一个紧密的蛋白复合体,与此一致,sap30bp和cdk11在全局剪接中发挥了高度类似的功能。进一步的机制研究证实,sap30bp能够稳定cyclin l的蛋白水平并促进其与cdk11的结合,从而激活cdk11的激酶活性。综上,sap30bp是cdk11的一个关键共激活因子,通过激活cdk11调控全局性rna剪接。
分子细胞卓越中心程红研究组博士生王常收、徐林、云昊,武汉大学周宇课题组博士生杜辰,大连化学物理研究所叶明亮课题组博士生王科云为本文的共同第一作者。分子细胞卓越中心程红研究员、武汉大学周宇教授、分子细胞卓越中心范静副研究员和大连化学物理研究所叶明亮研究员为论文的共同通讯作者。该项研究工作得到国家自然科学基金、国家重点研发计划项目、中国科学院、上海市科学技术委员会等多个项目资助。
文章链接:
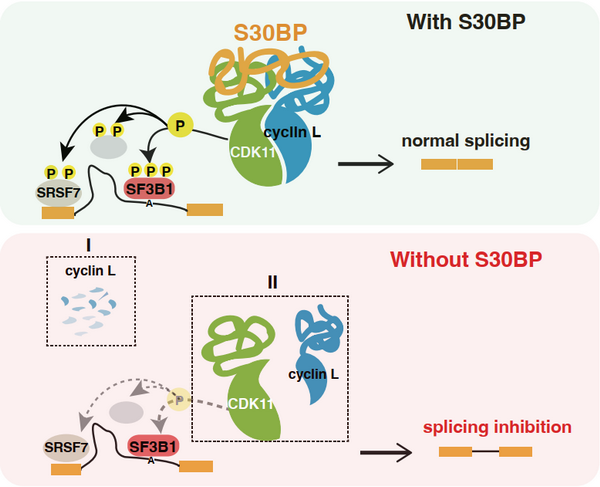
sap30bp调控全局pre-mrna剪接示意图
