周斌组合作揭示动脉稳态和疾病中内皮细胞增殖情况及调控机制
文章来源:分子细胞科学卓越创新中心 | 发布时间:2023-12-18 | 【】 【】
12月12日,国际学术期刊circulation在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周斌研究组与上海市胸科医院何奔研究组的最新合作研究成果“dynamics of endothelial cell generation and turnover in arteries during homeostasis and diseases”。该项工作利用双同源重组系统构建一种可以长时程不间断捕捉体内内皮细胞增殖的技术,揭示了在稳态、高血压和糖尿病状态下主动脉内皮细胞的增殖情况。
内皮细胞是心血管疾病基础研究中最重要的细胞之一,其完整性在心血管系统功能维持中发挥着重要作用。内皮细胞损伤和丢失与多种心血管疾病的发生发展有着密切关系,如高血压和糖尿病及其并发症。内皮细胞增殖或内皮祖细胞的分化是损伤血管新生内皮的主要来源。最早有研究发现在人外周血中存在内皮祖细胞,经过分离得到的内皮祖细胞在体外可以分化成内皮细胞且移植后可以参与新生血管形成。而后有多项研究利用骨髓移植或异体共生的方法,并没有在小鼠体内寻找到骨髓或外周血来源的内皮祖细胞。近期的一项研究也进一步否定了人体骨髓细胞中存在内皮祖细胞,提示新生血管内皮应是来自组织原有的内皮细胞增殖。最近的谱系追踪研究表明,损伤后的血管修复和再生是由内皮细胞增殖而来的,且其增殖能力存在异质性。依据体外克隆形成实验和谱系追踪,发现存在一些内皮亚群具有更高的增殖能力,如side population、procr 、c-kit 、sca1 的内皮细胞。但是这些研究大多从分子标志出发,而后验证表达这些标志的细胞都具有内皮祖细胞的特性,这也导致了不同研究提出的内皮祖细胞标志不同,这些细胞是否是同一细胞类群也不清楚。另外,大血管如主动脉的内皮细胞增殖率低,同时缺少可靠的细胞增殖记录方式,导致难以开展寻找主动脉中高增殖内皮亚群的研究。同时内皮细胞增殖率受体内复杂环境和血流模式的影响,在高血压、糖尿病等疾病状态下如何变化尚不清楚。基于此,何奔教授团队从研发高效标记内皮细胞增殖的谱系追踪方法出发,以寻求在维持血管稳态和疾病中的关键靶点。
ki67是细胞周期标记物,可以用于评估组织中发生增殖的细胞。然而ki67是瞬时表达在正在发生增殖事件的细胞,故ki67报告示踪鼠可以用于追踪特定时间点增殖的细胞,但对于主动脉内皮这种低增殖率的细胞检出效果较差。基于之前的研究,dre-rox与cre-loxp两种重组酶系统可以在细胞内互不干扰共同发挥作用。研究团队在此基础上,构建了ki67-cre-rox-er-rox (ki67-crexer),经dre重组酶剪切后变成ki67-cre,从而实现长时程标记dre重组之后发生增殖行为的细胞。首先他们构建了r26-dreer;ki67-crexer;r26-gfp (protracer)示踪鼠,实现标记他莫昔芬诱导后所有发生增殖的细胞。与传统的ki67-crexer;r26-gfp示踪鼠以及edu掺入相比,protracer鼠在主动脉内皮这种低增殖率的细胞具有更高的检出效率,每个月约有3%的内皮细胞发生增殖。
为了特异性检测内皮细胞的增殖,研究团队构建了cdh5-dreer;ki67-crexer;r26-gfp(ec-protracer)示踪鼠,实现特异性标记增殖的内皮细胞。与protracer鼠结果一致,随着时间的延长,发生增殖的内皮细胞越多。从荧光结果可以看出,增殖行为多为一分二的方式,同时会将两个相邻的细胞进行标记,作者定义了这种相邻两个细胞增殖方向与血流方向的关系,角度小于 30 定义为平行血流方向增殖,反之为垂直血流方向增殖。有趣的结果发现,这种增殖行为在主动脉内皮多为平行血流方向,在下腔静脉内皮则多为垂直血流方向。
先前的研究已表明,血流剪切力感应器piezo1参与调节内皮细胞重组以及脉管系统发育成熟。那piezo1是否参与调节血管内皮增殖及增殖方向呢?作者在protracer示踪鼠的基础上构建了piezo1敲除小鼠,发现其主要与主动脉内皮增殖方向有关,与增殖能力及静脉内皮的增殖无关。
如前所述,内皮细胞存在异质性,增殖能力有差别,本研究的荧光结果也表明内皮细胞增殖能力存在差异。单细胞转录组测序可以有效区分这些存在差异的细胞亚群。作者将稳态条件下诱导标记八周的protracer鼠进行单细胞转录组测序,将内皮细胞提取出来进行亚群分析。基于是否表达gfp,可以将细胞分为发生增殖事件的细胞和未增殖的细胞。结果发现ec-1亚群(较为特异性表达ly6c的亚群)具有更强的细胞增殖能力,拟时序分析也发现这群细胞分化程度更低,同时表达干细胞的标记物如sca1、sox18等。这些结果表明ly6c ec-1亚群具有内皮祖细胞的特征。
为了探究影响内皮细胞增殖的分子机制,作者发现vegfr2(基因名kdr)在ec-1中具有显著的表达。也有文章报道yap1参与内皮细胞对机械压力的反应从而引起内皮细胞的炎症,但其是否能调节内皮细胞增殖仍不清楚。故作者在protracer鼠基础上构建了基因敲除kdr或yap1,发现分别敲除kdr和yap1之后,主动脉和静脉的内皮增殖信号均显著降低,且在yap1敲除后kdr的表达水平也显著降低,提示yap1可能部分通过kdr影响内皮细胞的增殖,即hippo/vegfr2通路调控大血管内皮细胞的增殖。
为了探究主动脉内皮细胞在疾病中的变化情况,作者在示踪鼠的基础检测了高血压与糖尿病模型中内皮细胞的增殖情况。有趣的结果发现,在这两种慢性病中,内皮细胞增殖在高血压组增加,而在2型糖尿病(t2d)组减少。在t2d中,尽管内皮增殖程度是降低的,但是ec-1细胞的增殖能力仍然高于其他内皮,如何恢复这群细胞的增殖分化能力可作为干预2型糖尿病血管损伤靶标。以上研究揭示了稳态和高血压、糖尿病状态下大血管内皮细胞增殖的异质性,寻找到一群具有高增殖潜能的内皮细胞亚群,并探讨了影响其增殖的分子机制,为以后预防高血压、糖尿病的血管病变提供新思路。
上海市胸科医院博士后李逸,分子细胞卓越中心博士研究生刘子鑫,上海市胸科医院博士后韩溪檬和博士研究生梁枫为该论文共同第一作者。上海市胸科医院何奔教授和分子细胞卓越中心周斌研究员为该论文共同通讯作者。该项工作得到了国家重点研发计划、国家自然科学基金、中国科学院、上海市及新基石科学基金等项目资助。
文章链接:
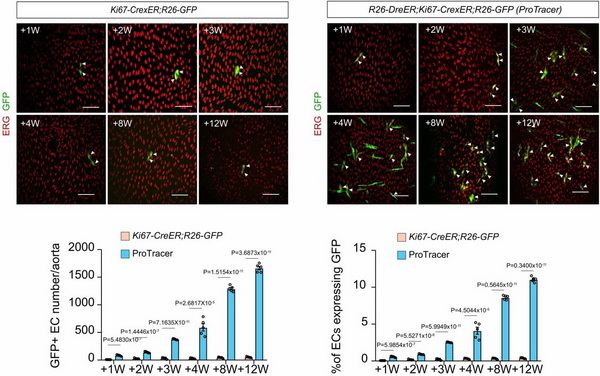
传统ki67示踪和protracer示踪细胞增殖效率对比
