营养与健康所陈雁研究组发现肠道mct1在介导乳酸转运和调控代谢稳态中的性别差异
文章来源:上海营养与健康研究所 | 发布时间:2023-11-08 | 【】 【】
11月6日,中国科学院上海营养与健康研究所陈雁研究组在国际学术期刊life metabolism在线发表了题为“intestinal monocarboxylate transporter 1 mediates lactate transport in the gut and regulates metabolic homeostasis of mouse in a sex-dimorphic pattern”的研究论文。该研究发现,肠道单羧酸转运蛋白mct1能够介导肠上皮的乳酸转运,并通过影响肠道巨噬细胞和炎症水平调控雄性小鼠的糖代谢稳态。同时,该研究也揭示了肠道mct1影响的相关代谢表型在雌雄小鼠存在明显的性别差异及其可能的机制。
单羧酸转运蛋白家族(monocarboxylate transporters, mcts)是一类负责转运乳酸等单羧酸类物质的跨膜转运蛋白,在乳酸、丙酮酸和短链脂肪酸(short chain fatty acids, scfas)等物质在组织器官中的转运,以及维持机体碳水化合物、脂质等物质的代谢稳态中发挥了重要的作用。其中,mct1更广泛地表达于各种组织器官,能转运包括乳酸在内的大多数短链单羧酸。经典研究理论一直认为乳酸是糖酵解的副产品或代谢废物,对机体具有损害作用。近年来,乳酸的多种生物学效应不断被发现,除了作为能量代谢的底物进入tca循环以外,还参与了调节信号转导、蛋白修饰等作用。特别是随着“乳酸穿梭”(lactate shuttle)理论假说的提出,人们对乳酸在新陈代谢中的作用得到了更加深刻的认识。该理论认为乳酸可以通过单羧酸转运体(如mct1)从一种类型的细胞转移到另一种类型的细胞。相关研究表明,乳酸在机体内的穿梭更多是作为一种代谢缓冲剂或调节剂,并产生诸多的生物学效应。
在实验室前期的研究中,研究人员发现了mct1在脂肪组织中介导乳酸的外排,并参与调控肥胖导致的胰岛素抵抗(diabetes,2022);另外,mct1在肝脏中同样介导乳酸外排,并且影响肝细胞的脂质代谢和肝脏脂肪变性(metabolism,2023)。鉴于乳酸在机体代谢和信号网络中的重要性,并鉴于肠道作为营养消化与吸收的关键部位和机体最大的免疫器官(由于肠道相关淋巴组织(gut-associated lymphoid tissue,galt)的存在),因此从糖脂代谢的层面对肠道mct1的功能和机制展开研究,对于理解代谢性疾病的发病机理和探索新的治疗靶点将具有十分重要的意义。
陈雁研究组通过构建肠上皮特异性敲除mct1的小鼠,发现mct1敲除能够影响多种代谢表型,并且很多表型具有性别特异性。其中,肠道mct1敲除可以改善雄性小鼠的糖代谢稳态,增强葡萄糖耐受和胰岛素敏感性,但对雌性小鼠的脂代谢功能和体重具有消极影响。通过对敲除小鼠肠道的转录组进行分析发现,mct1肠道特异性敲除对特定基因表达的影响存在明显的性别差异。其中,雄鼠的差异基因主要富集在与炎症相关的信号通路。进一步的实验表明雄鼠在肠道敲除mct1后肠道组织间液的乳酸浓度降低,血液中炎性因子tnf 和趋化因子ccl2水平降低,肠道巨噬细胞的浸润下降,同时肠道抗炎蛋白reg3家族基因表达升高,而这些表型并未在雌鼠中观测到。另外,研究发现,对雄鼠进行雌激素处理可以降低肠道组织间液的乳酸水平,并消除由于mct1敲除引起的糖代谢改善表型。该项研究中的动物实验证实mct1介导了乳酸和短链脂肪酸由肠道向门静脉转运的过程。最后,研究人员还发现mct1肠道敲除也引起了雄性小鼠肠道菌群的改变,并通过抗生素清除菌群和菌群移植实验表明mct1肠道敲除在雄鼠中改善糖代谢的表型在一定程度上受到肠道菌群的调节。
此项研究的结果表明了mct1介导的乳酸转运在调控机体糖脂代谢稳态中发挥了重要作用,为预防和治疗糖脂代谢紊乱相关的代谢性疾病提供了新的研究思路和潜在靶点,为今后依据不同性别干预代谢性疾病提供了理论依据。
中国科学院上海营养与健康研究所助理研究员王烁博士为该论文的第一作者,陈雁研究员为通讯作者。研究得到了国家自然科学基金委及上海市重大科技项目的资助,同时也得到了中国科学院上海营养与健康研究所所级公共技术中心分析测试技术平台、实验动物技术平台的支持。
文章链接:
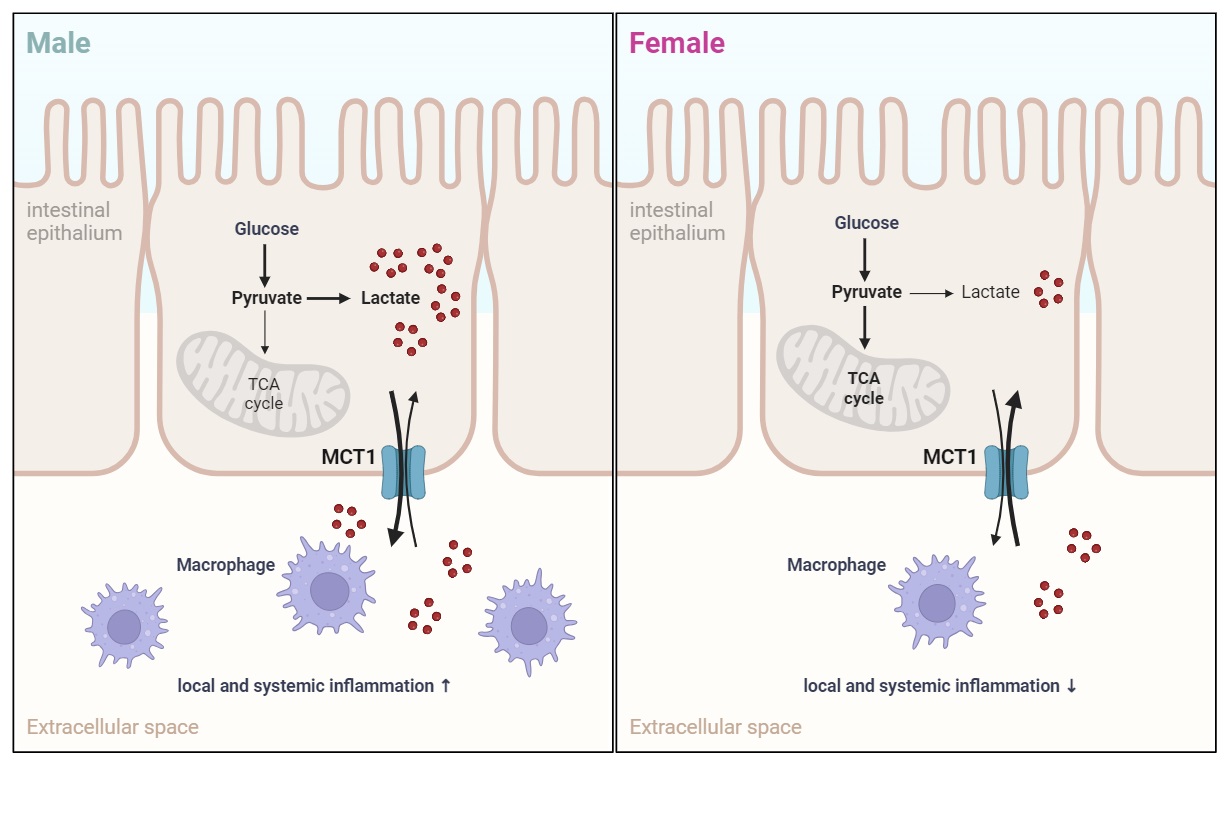
图注:肠道mct1以性别二态性的方式影响代谢稳态
