甲基苯丙胺(meth,冰毒的主要成分)是一种合成药物,在20世纪早期被广泛用于治疗鼻塞、哮喘、肥胖以及嗜睡等症状。然而,随着meth的成瘾特性显现和滥用,导致它被医学应用中逐渐淘汰反而进入地下市场,成为被广泛滥用的毒品之一,通常被称为“冰毒”或“猪肉”等。目前尚无fda批准的药物用于治疗meth成瘾。因此,研究meth与其靶点蛋白的相互作用的分子机制对于开发治疗药物成瘾的新药具有关键意义。
meth成瘾主要通过调控多巴胺释放和再摄取产生作用,这个机制已得到广泛认可。最新研究显示,meth可以直接与痕量胺相关受体(taar1)结合并激活受体下游的g蛋白信号通路,该相互作用可能成为研究meth在体内进行信号转导的关键节点。此外,taar1被认为在调节meth以及其他胺类分子(如内源性苯乙胺)以及精神分裂症等疾病临床候选药物分子的神经生物效应中发挥着关键作用。因此,通过结构生物学研究手段深入探究meth以及其他胺类分子与taar1之间的相互作用机制,有望为治疗药物成瘾和研发新型抗精神类药物提供重要支撑。
2023年11月7日,中国科学院上海药物研究所的徐华强团队联合上海科技大学ihuman研究所的徐菲课题组、分子卓越创新中心的汪胜团队以及上海市刑事科学技术研究院,在《 nature》杂志上以“文章加速预览(accelerated article preview,aap)”形式在线发表了题为《recognition of methamphetamine and other amines by trace amine receptor taar1》的最新研究成果。
taar1是一种g蛋白偶联受体,主要分布在大脑中,能够识别多种生物胺类物质,包括内源物质 -苯乙胺( -pea),并参与神经递质的调节。与其他痕量胺受体不同,taar1主要分布在大脑的单胺能核团及其投射区,例如多巴胺能的腹侧被盖区和黑质致密部,5-羟色胺能的中缝核,以及谷氨酸能的皮质、杏仁核等脑区。这与taar1在调节奖赏回路、边缘系统、认知过程和情感状态等方面的关键作用高度一致。因此,taar1的独特生理功能与多种精神疾病和药物成瘾密切相关。已经证明taar1激动剂对治疗精神分裂症、抑郁症和药物成瘾具有潜力。
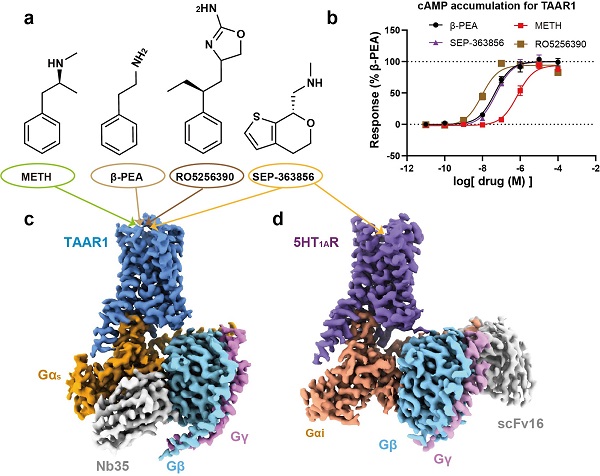
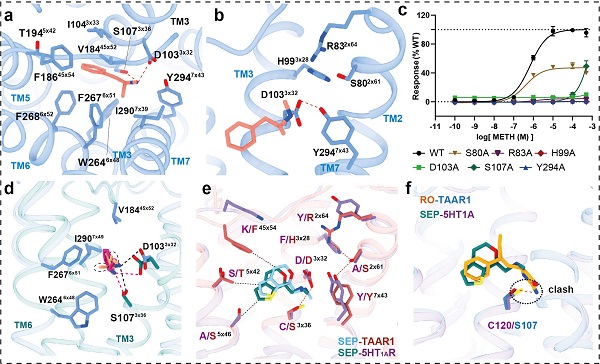
在该项研究中,研究人员利用冷冻电镜技术首次确定了人源taar1-g s蛋白复合物分别与meth、内源配体 -pea,以及选择性激动剂ro5256390和临床候选药物sep-363856激活后的高分辨率结构 (图1)。通过结构分析,研究人员发现meth定位在taar1的正构结合口袋中,主要通过与103位的天冬氨酸和294位的酪氨酸形成的极性相互作用来特异性地与taar1结合(图2a-b)。此外,配体结合口袋及其周围所形成氢键网络有助于稳定配体与taar1的相互作用(图2b-c)。taar1中的第二个胞外环(ecl2)形成较特殊的“盖子”结构,并利用与其他单胺类受体差异较大的第186位苯丙氨酸以及其他疏水氨基酸直接或间接参与配体相互作用,形成taar1特有的分子识别机制 (图2a)。与内源配体 -pea相比,meth与关键残基第103位的天冬氨酸和107位的丝氨酸的极性相互作用较弱,导致其与taar1的亲和力下降,这可能是 -pea比meth更高效结合taar1的结构基础(图2d)。研究还通过分子动力学模拟以及系统的突变与功能实验验证了上述结论。
图1,四种 taar1 激动剂激活 taar1 的功能评估及 taar1-gs,5ht1a-gi复合物的整体结构。(a)四种taar1激动剂的结构式(b)四种配体激活taar1的功能评估(c-d)taar1-gs,5ht1a-gi复合物的整体结构密度图。
此外,研究还解析了其他具有临床研究潜力的药物,如双靶点胺类化合物sep-363856(临床候选药物,又名ulotaront)和taar1选择性激动剂ro5256390,分别激活taar1的复合物结构,揭示了这两个化合物分别在多重药理学和选择性作用中的分子机制 (图1)。例如,sep-363856对taar1和5-ht1a受体均具有激动剂活性,但对taar1的激活效能更高。结构比对分析发现,尽管两者的结合口袋存在一定的相似性,但taar1特有的极性相互作用网络有助于增强sep-363856的亲和力(图2e)。ro5256390对taar1的高亲和力和高度选择性的分子机制在于其2-胺基噁唑基团与taar1结合口袋的氨基酸残基形成额外的相互作用,而在5-ht1a受体的结合口袋中则会引起位阻(图2f)。这些发现为精准设计新型药物提供了理论基础。
图2,taar1复合物的结构分析和功能验证(a)meth定位于taar1受体的正构结合口袋;(b-c)taar1结构中的氢键网络稳定配体和第103位天冬氨酸,第294位酪氨酸的相互作用(b)及其功能验证(c);(d)meth和 -pea在taar1结合口袋中的相互作用差异;(e)sep-363856激活taar1受体和5ht1a受体的相互作用比较; (f)结构比对表明ro5256390在5-ht1a受体的结合口袋中会引起位阻,因而难以激活5-ht1a受体。
综上而言,这项研究代表了meth研究领域的一个里程碑,其研究成果将带动一系列广泛和深远的影响,有望开辟一个超越经典神经递质如5-羟色胺和多巴胺的生物胺研究新领域。这项研究系统性地揭示了meth和其他胺类化合物与taar1相互作用的关键结构要素,为治疗药物成瘾和神经精神疾病的新药研发提供了坚实的基础。同时,taar1作为单胺类系统的最后一个未解析结构的受体,该研究填补了现有胺能受体结构领域的空白,对于理解单胺类系统的药效学研究具有重要意义,有望推动新一代更有效药物的开发。
值得一提的是,上海药物研究所的徐华强团队长期致力于研究与药物成瘾相关的科学问题。他们在2022年和2023年分别与国内外顶尖团队合作,在《cell》杂志上发表了两篇重要文章,系统地阐述了阿片受体与多种小分子镇痛药和内源性阿片肽之间的作用机制,为相关研究领域提供了坚实的结构药理学基础。这些工作突出了徐华强研究员及其团队在解决与药物成瘾有关的重要科学问题方面的杰出工作。
本研究中的冷冻电镜数据由上海药物所高峰电镜中心和上海科技大学生物电镜平台收集。上海药物研究所刘恒博士、王悦博士、上海科技大学2023届博士毕业生郑优,分子卓越创新中心博士研究生王雨朦为该论文的共同第一作者。徐华强研究员、徐菲研究员、汪胜研究员,刘文斌研究员为共同通讯作者。该项研究获得了包括中国科技部、国家自然科学基金、上海市科技重大专项、中国科学院战略性先导科技专项等经费的资助。
全文链接:
相关文章:
科学插图,展示了taar1受体在大脑中识别成瘾药物 meth 分子的结构基础。